
Неорганическая химия - 2 - - Кондратов Е.А.
Кемеровский технологический институт пищевой промышленности
Кафедра общей и неорганической химии
Кондратов Е.А.
Томск-2003
№ 1
Вычислите: а) относительную молекулярную массу фосфорной кислоты и б) массу одной молекулы фосфорной кислоты (в граммах).
• a. 98, б. 1.63*10-24.
№ 2
Масса одной молекулы некоторого вещества имеет массу 2.99*10-23 г. Вычислите относительную молекулярную массу этого вещества.
• (18)
№ 3
Вычислите объем (дм3), который займут 6.02*22 молекул хлора при нормальных условиях.
• (2.24)
№ 4
Закончите уравнение реакции:
H2SO4+2NaOH →
Определите для серной кислоты: а) молярную массу (г/моль), б) фактор эквивалентности (f = 1/z), в) молярную массу эквивалентов: Мэкв=М*1/z (г/моль) в этой реакции.
• (98, 1/2, 49)
№ 5
Закончите уравнение реакций между приведенными веществами:
H3SО3+2NaOH →
Для сернистой кислоты определите в указанной реакции: а)молярную массу (г/моль), б) фактор эквивалентности (f = 1/z), в)молярную массу эквивалентов (г/моль).
• (82, 1/2, 41)
№ 6
Определите: а) молярную массу эквивалентов окислителя (г/моль) и б) молярную массу эквивалентов восстановителя (г/моль) в данной окислительно-восстановительной реакции:
HNO3(конц)+Cu →
• (63, 32)
№ 7
На восстановление 3,17 г оксида металла израсходовано 1.78 дм3 (н.у.) водорода. Определите молярную массу эквивалетнов металла.
• (11.95)
№ 8
На нейтрализацию 14,7 г ортофосфорной кислоты израсходовано 12 г гидроксида натрия. Определите: а) молярную массу эквивалентов кислоты (г/моль) б) основность кислоты в данной реакции.
• (49, 2)
№ 9
Из 1,3 г гидроксида металла получено 2,85 г его сульфата. Вычислите молярную массу эквивалентов металла (г/моль).
• (49.26)
№ 10
1,6 г кальция и 2,61 г цинка вытесняют из раствора кислоты одинаковые объемы водорода. Вычислите молярную массу эквивалентов цинка (г/моль), если молярная масса эквивалентов кальция равна 20 г/моль.
• (32.7)
№ 11
Корпускулярно-волновая природа частиц описывается уравнением Луи де Бройля.
• λ=h/|mV|.
№ 12
Сколько квантовых чисел характеризует состояние электрона в атоме?
• (4)
№ 13
Что характеризует главное квантовое число?
• Энергию электрона.
• Размеры орбитали.
№ 14
Что характеризует орбитальное квантовое число?
• Пространственную форму орбитали.
№ 15
Что характеризует магнитное квантовое число?
• Ориентацию орбитали в пространстве.
№ 16
Какие значения принимает спиновое квантовое число?
• +1/2
• -1/2
№ 17
Какова максимальная ёмкость: а) s-, б) p-, в) d- и г) f- подуровней?
• (2, 8, 10, 14)
№ 18
Выберите последовательность рамещения электронов по подуровням:
• 4s3d
• 4f5d
№ 19
Расположите положите приведённые энергетические подуровни атома 5p, 5s, 4d в порядке последовательного возрастания их энергии.
• (5s4d5p)
№ 20
Валентные электроны атомов химических элементов: а) ...5s25p2; б)…4s23d3. В каких периодах и группах находятся эти элементы?
• (5, 4)
№ 21
Признаки, по которым молулярную частицу можно отнести к молекулам:
• Отсутствует заряд и неспаренные электроны.
№ 22
Сколько механизмов образования ковалентной связи известны?
• (2)
№ 23
Сколько неспаренных электронов имеет атом cеры: а) в стационарном и б) возбуждённом состояниях (2 значения)?
• (2, 4, 6)
№ 24
Сколько неспаренных электронов имеет атом хлора: а) в стационарном и б) возбуждённом состояниях (3 значения)?
• (1, 3, 5, 7)
№ 25
Тип гибридизации центрального атома в молекулярной частице BF-4
• sp3.
№ 26
Тип гибридизации центрального атома в молекулярной частице BeF2.
• sp.
№ 27
Частицы, содержащие центральный атом в sp3- гибридном состоянии.
• CH4.
№ 28
Рассмотрите с точки зрения метода валентных связей (МВС) строение и установите геометрическую структуру молекулярной частицы SF6.
• октаэдр.
№ 29
Расположите молекулярные частицы 1. HCl, 2. HF, 3. HBr, 4. HJ в порядке увеличения их дипольного момента.
• (4, 3, 1, 2)
№ 30
Рассмотрите с точки зрения метода валентных связей (МВС) строение и установите геометрическую структуру молекулярной частицы РF5.
• тригональная бипирамида.
№ 31
Какой молекулярной частице принадлежит приведённая энергетическая диаграмма? Укажите для неё: а) молекулярную формулу, б) порядок связи.
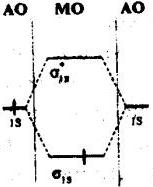
• a. He, б. 1/2.
№ 32
Какая из молекулярных частиц является более прочной: 1. F2 или 2. F2+.
• (2)
№ 33
Укажите магнитные свойства молекулрных частиц: а) F2 и б) F2+.
• а) – парамагнитная; б) - диамагнитная.
№ 34
Какой молекулярной частице принадлежит приведённая энергетическая диаграмма? Укажите для неё: а) молекулярную формулу, б) порядок связи.
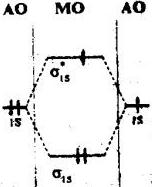
• He2+; б) 1/2.
№ 35
Определите порядок связи в молекулярных частицах: а) N2 и б) N2+.
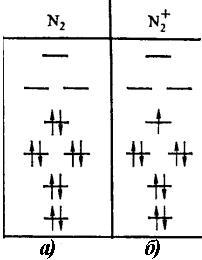
• (3, 2.5)
№ 36
Каким частицам принадлежат энергетические диаграммы?
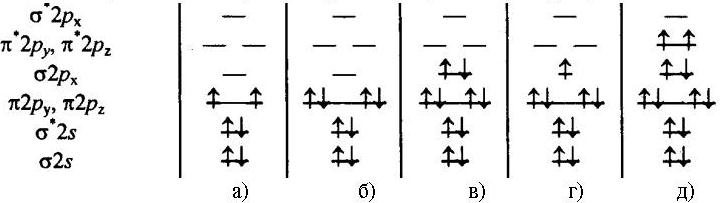
1. C2
2. B2
3. N2
4. O2
5. N2+
Установите соответствие между диаграммами и перечисленными частицами.
• (2, 1, 3, 5, 4)
№ 37
Каким частицам принадлежат энергетические диаграммы?
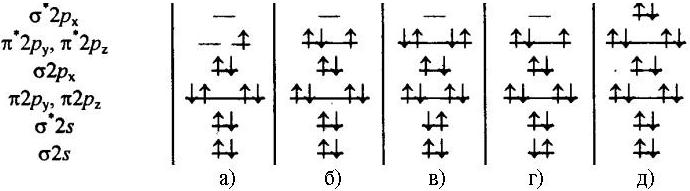
1. O2+
2. F2
3. Ne2
4. O2-
5. F2+
• (1, 4, 2, 5, 3)
№ 38
Определите для частицы 1. порядок связи и 2. магнитные свойства пара- или диамагнитная.
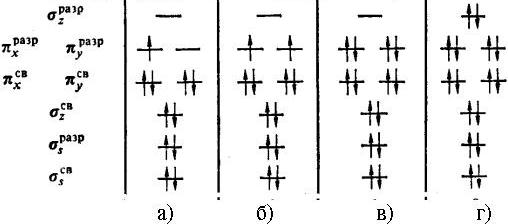
• порядок связи 2,5; парамагнитная.
№ 39
Какая из молекулярных частиц является более прочной: 1. O20 и 2. О2-?
• (1)
№ 40
Какая из молекулярных частиц является более прочной: 1. B20 и 2. B2-?
• (1)
№ 41
Прямая или обратная реакция будет протекать при стандартных условиях в системе:
3Fe2O3(k)+CO(г)=2Fe3O4(к)+CO2(г)
ΔG0f,298 -740,3 -137,1 -1014,2 -394,4
Значения стандартных энергий Гиббса образования веществ приведены в порядке, соответственно формулам веществ (кДж/моль).
• прямая.
№ 42
Прямая или обратная реакция будет протекать при стандартных условиях в системе:
CuO(k)+H2(г)=Cu(к)+H2O2(г)
Δ H0f,298 -162,0 0 0 -241,81
S0298 42,63 130,52 33,14 188,72
Ответ дать на основании вычисления Δ G0298 реакции.
• обратная.
№ 43
Прямая или обратная реакция будет протекать при стандартных условиях в системе:
3Fe2O3(k)+CO(г)=2Fe3O4(к)+CO2(г)
Δ G0f,298 -740,3 -137,1 -1014,2 -394,4
Значения стандартных энергий Гиббса образования веществ приведены под формулами веществ (кДж/моль).
• прямая.
№ 44
Прямая или обратная реакция будет протекать в стандартных условиях:
2С(графит)+2Н2(г)=С2Н4(г)
5,74 130,6 219,4
Значения стандартных энтропий, S0298 (Дж/моль*К) приведены под формулами веществ.
• обратная.
№ 45
Прямая или обратная реакция будет протекать при стандартных условиях в системе:
NH3(г)+3O2(г)=2N2(к)+6H2O(г)
Δ G0f,298 -16,7 0 0 -228,6
Значения стандартных энергий Гиббса образования веществ приведены под формулами веществ (кДж/моль).
• обратная.
№ 46
Вычислите тепловой эффект реакции горения 1 моль этана:
С2Н6+7/2 О2=2СО2+3Н2О
Δ H0f,298, кДж/моль -84,67 0 -393,51 -241,81
Значения стандартных энтальпий образования веществ приведены под формулами веществ.
• - 1437,84.
№ 47
Вычислите тепловой эффект реакции горения 1 моль метана:
СН4+2О2=СО2+2Н2О
Δ H0f,298, кДж/моль -74,85 0 -393,51 -241,81
Значения стандартных энтальпий образования веществ приведены под формулами веществ.
• –802,28.
№ 48
Исходя из значений стандартных энергий Гиббса образования веществ (Δ G0f,298) рассчитайте: а) Δ G0298 (в кДж) следующей реакции и б) определите направление протекания процесса при стандартных условиях (прямая или обратная реакция протекает):
2CO(г)+О2(г)=2CO2(г)
Δ G0f,298 -137,1 -394,4
• а) -514,6; б) прямая.
№ 49
Определите направление самопроизвольного протекания процесса (прямая или обратная реакция протекает):
Fe2O3(к)+3CO(г)=2Fe(к)+3CO2(г)
Δ H0f,298 -821,32 -110,5 0 -393,51
S0298 89,96 197,4 27,15 213,6
• прямая реакция.
№ 50
Реакция горения метилового спирта протекает по уравнению:
СН3ОН(ж)+3/2 О2(г)=СО2(г)+2Н2О(ж), Δ #2(H,298,0)$=$minus$726$%$5$кДж
Δ H0f,298 ? 0 -393,51 --285,84
Вычислите теплоту образования метилового спирта (кДж/моль).
• –238,69.
№ 51
Вычислите массовую долю (%) водного раствора глицерина С3Н5(ОН)3, зная, что этот раствор кипит при 100.39° С. Эбуллиоскопическая константа воды 0.52 кг*К*моль-1.
• 6,45.
№ 52
Вычислите молярную массу неэлектролита (г/моль), зная, что раствор, содержащий 2,25 г этого вещества в 250 г воды, кристаллизуется при -0.279° С. Крископическая константа воды 1.86 кг*К*моль-1.
• 60.
№ 53
Вычислите температуру кипения (° С) 5%-ного раствора нафталина C10H8 в бензоле. Температура кипения бензола 80.2° С. Эбуллиоскопическая константа бензола 2.57 кг*К*моль-1.
• 81,25.
№ 54
Раствор, содержащий 25,65 г некоторого неэлектролита в 300 г воды, кристаллизуется при -0.465° С. Вычислите молярную массу (г/моль) растворённого вещества. Криоскопическая константа воды 1.86 кг*К*моль-1.
• 342.
№ 55
Вычислите криоскопическую константу уксусной кислоты (кг*К*моль-1), зная, что раствор, содержащий 4,25 г антрацена С14Н10 в 100 г уксусной кислоты, кристаллизуется при 15.718° С. Температура кристаллизации уксусной кислоты 16.65° С.
• 3,9.
№ 56
При растворении 4,86 г серы в 60 г бензола температура кипения его повысилась на 0.81°. Сколько атомов содержит молекула серы в этом растворе. Эбуллиоскопическая константа бензола 2.57 кг*К*моль-1.
• 8.
№ 57
Температура кристаллизации раствора, содержащего 66,3 г некоторого неэлектролита в 500 г воды, равна -0.558° С. Вычислите молярную массу растворенного вещества (г/моль). Криоскопическая константа воды 1.86 кг*К*моль-1.
• 442.
№ 58
Какую массу анилина (г) C6H5NH2 следует растворить в 50 г диэтилового эфира, чтобы температура кипения раствора была выше температуры кипения диэтилового эфира на 0.530°. Эбуллиоскопическая константа диэтилового эфира 2.12 кг*К*моль-1.
• 1,16.
№ 59
Вычислите температуру кристаллизации (° С) раствора этилового спирта C2H5OH с массовой долей 2%. Криоскопическая константа воды 1.86 кг*К*моль-1.
• -0,82.
№ 60
Вычислите массовую долю (%) водного раствора глюкозы С6Н12О6, зная, что этот раствор кипит при 100.26° С. Эбуллиоскопическая константа воды 0.52 кг*К*моль-1.
• 8,25.
№ 61
В 100 г воды растворено 9,0 г сахарозы. Определите моляльность (моль/кг) и молярную концентрацию (моль/дм³) сахарозы в растворе (плотность раствора 1.07 г/см³).
• 0,26; 0,26.
№ 62
Вычислите массовую долю ω (%) и молярную концентрацию С(Х) в растворе, полученном растворением 1,5 моль уксусной кислоты в 0.75 дм³ воды (плотность раствора принять равной 1 г/cм³).
• ()
№ 63
Вычислите для раствора сульфата натрия, полученном растворением 60 г вещества в 240 см³ воды: а) массовую долю ω (%) и б) молярную концентрацию (моль/дм³). Плотность раствора составляет 1.133 г/см³.
В ответ введите: массовую долю и молярную концентрацию.
• (20.00 1.60)
№ 64
Определите: а) молярную концентрацию (моль/дм³) и б) моляльность фтороводорода (моль/кг) в водном растворе с массовой долей вещества 10 % (плотность раствора 1.06 г/см³).
• а) 5,30; б) 5,56.
№ 65
Вычислите для водного раствора сульфата калия с массовой долей, ω = 20% (ρ=1.125 г/см³): а) молярную концентрацию (моль/дм³) и б) молярную концентрацию эквивалентов.
• а) 1,29; б) 2,58.
№ 66
Рассчитайте: а) масcу нитрата натрия (г) и б) объём воды (см³), необходимые для приготовления 500 см³ раствора с массовой долей ω (NaNO3) = 16%. Плотность полученного раствора, ρ=1.15 г/cм³.
• а) 92; б) 483.
№ 67
Определите: а) молярную концентрацию (моль/дм³) и б) молярную концентрацию эквивалентов (моль/дм³) раствора серной кислоты с массовой долей ω (H2SO4) =15% и плотностью 1,105 г/см³.
• а) 1,5; б) 3,0.
№ 68
Найдите объем раствора (см³) с массовой долей серной кислоты 96 % и плотностью 1,84 г/см³, необходимый для приготовления 250 см³ раствора с молярной концентрацией растворенного вещества 0,1 моль/дм³.
• 1,4.
№ 69
Рассчитайте: а) массу NaCl и б) объём воды, необходимые для приготовления 500 см³ раствора с массовой долей 15%. Плотность полученного раствора 1,13 г/cм³.
• а) 84.75; б) 480.25.
№ 70
Чему равна молярная концентрация эквивалентов раствора серной кислоты с молярной концентрацией 0,1 моль/дм³?
В ответ введите Сэкв(H2SO4)
• (0.2)
№ 71
Вычислите рН водных растворов: а) серной и б) фтороводородной кислот с молярной концентрацией вещества 0.01 моль/дм³. Константа диссоциации фтороводородной кислоты 6.7*10-4.
В ответ введите: рН раствора серной кислоты и рН раствора фтороводородной кислоты.
• (1.7 1.6)
№ 72
Вычислите рН водных растворов: а) гидроксида калия б) гидроксида бария с молярной концентрацией вещества 0.01 моль/дм³.
В ответ введите: рН раствора КОН и рН раствора Ва(ОН)2.
• (12 12.3)
№ 73
Соли, водные растворы которых имеют рН>7:
• Na2CO3,
• MgCl2.
№ 74
Вычислите рН водных растворов: азотной и азотистой кислот с молярной концентрацией вещества 0.1 моль/дм³. Константа диссоциации азотистой кислоты 4.0*10-4.
В ответ введите: рН раствора серной кислоты и через пробел рН раствора фтороводородной кислоты.
• (1 1.2)
№ 75
Соли, водные растворы которых имеют рН<7:
• FeSO4,
• CuSO4.
№ 76
Укажите продукты реакции, образующиеся при сливании водных растворов солей: сульфата алюминия и карбоната натрия.
• Al(OH)3, CO2, Na2SO4.
№ 77
Используя значение Кг, укажите, какая из двух солей гидролизуется сильнее при одинаковых молярных концентрациях:
1. NaF(КдHF=6.8*10-4 2. NaCN(КдHCN=6.2*10-10).
• (2)
№ 78
Рассчитайте: а) константу гидролиза, Кг и б) рН раствора цианида натрия с молярной концентрацией эквивалентов 0,01 моль/дм³. Константа диссоциации цианводородной кислоты 4.9*10-10.
• а. 2.0*10-5, б. 12.65.
№ 79
Соли, гидролизующиеся по катиону:
• NaNO3,
• ZnCl2.
№ 80
Соли, гидролизующиеся по аниону:
• Na3PO4,
• NaNO2.
№ 81
Определите для комплексного соединения: а) заряд комплексного иона, б) координационное число и в) заряд комплексообразователя: [PtH2O(NH3)3Br2]SO4.
• 2+ б) 6 в) 4+.
№ 82
Определите для комплексного соединения: а)заряд комплексного иона, б) координационное число и в) заряд комплексообразователя: [Zn(NH3)4]Cl2.
• 2+ б) 4 в) 2+.
№ 83
Определите для комплексного соединения: а)заряд комплексного иона, б) координационное число и в)заряд комплексообразователя: K3[Fe(CN)6].
• 3- б) 6 в) 3+
№ 84
Какое из соединений называется гексацианоферрат(III) калия (красная кровяная соль)?
• K3[Fe(CN)6].
№ 85
Установите геометрическую структуру комплексного иона [Zn(NH3)4]2+.
• тетраэдр.
№ 86
Установите геометрическую структуру комплексного иона [Ag(NH3)2]+.
• линейная.
№ 87
Установите геометрическую структуру комплексных иона [Fe(CN)]63-.
• октаэдр.
№ 88
Какой из комплексных ионов: 1. [Zn(CN)4]2- (Кнест=2.4*10-20) или 2. [Zn(NH3)4]2+ (Кнест=3.4*10-10) является более прочным?
• (1)
№ 89
Какой из двух ионов: 1. [Co(NH3)6]3+ или 2. [СoF6]3- является внутриорбитальным (низкоспиновым)?
• (1)
№ 90
В какую сторону (в левую или в правую) смещено равновесие реакции:
[HgCl4]+4I- ⇔ [HgI4]+4Cl-
Кнест=8.5*10-16
Кнест=1.5*10-30
• в правую.
№ 91
Какие реакции являются окислительно-восстановительными?
• 2KMnO4=K2MnO4+MnO2+O2.
• 3Сl2+6KOH=5KCl+KClO3+3H2O.
• 2CuI2=2CuI+I2.
№ 92
В каких соединениях центральный атом имеет: высшую и низшую степени окисления ?
• (NH4)2 Cr2 O7 - с низшей степенью окисления.
• CrCl2 с высшей степенью окисления.
№ 93
Вещества-окислители:
• KMnO4,
• (NH4) 2Cr2 O7.
№ 94
Вещества-восстановители:
• NH3,
• Zn.
№ 95
Какие из соединений проявляют окислительно-восстановительную двойственность:
• S,
• K2MnO4,
• Cl2.
№ 96
Составьте схему процесса восстановления для реакции, протекающей по схеме:
KMnO4+NaI+H2SO4 → MnSO4+I2+K2SO4+H2O
и укажите: а) число ионов водорода; б) число электронов, участвующих в процессе восстановления.
• (8 5)
№ 97
Составьте схему процесса восстановления для реакции, протекающей по схеме:
MnSO4+KClO+KOH → MnO2+KCl+K2SO4+H2O
и укажите: а) число гидроксид-ионов; б) число электронов, участвующих в процессе восстановления.
• (2 2)
№ 98
Составьте ионно-молекулярное уравнение реакции, протекающей по схеме:
Cr2O72-+H++e → Cr3++H2O
и укажите: а) число протонов, участвующих в процессе; б) число электронов.
• (14 6)
№ 99
Для каких систем система (А) является окислителем: (А) Cr2O72-+14H++6e=2Cr3++7H2O Eo=+1.33 B.
• H2SO3+4H++4e=S+3H2O Eo=+0.45 B.
• NO+2H++e=NO2+H2O Eo=+0.80 B.
• J2(кр)+2e=2J- Eo=+0.54 B.
№ 100
Выбрать значение фактора эквивалентности (f=1/z) окислителя впроцессе восстановления Cr2O72- в кислой среде
• 1/6.
№ 1
Строение внешнего электронного слоя атомов элементов VIIA -группы.
• ns2np5.
№ 2
Какую постоянную степень окисления проявляет фтор в соединениях?
• (-1)
№ 3
Положительные степени окисления хлора в соединениях.
• (+1; +3; +5; +7)
№ 4
Как изменяются в ряду F - Cl - Br - I - At свойства галогенов:
• радиус нейтрального атома увеличивается, относительная электроотрицательность уменьшается.
№ 5
Как изменяются в ряду F - Cl - Br - I - At свойства галогенов:
• неметаллические свойства ослабевают, окислительная активнось ослабевает.
№ 6
Какие галогены в свободном виде получают электролизом?
• Хлор, Фтор.
№ 7
Расставьте коэффициенты в уравнении реакции получения хлора в лаборатории, протекающей по схеме:
HCI+MnO2 → Cl2+MnCl2+H2O. Укажите сумму всех коэффициентов.
• (9)
№ 8
Как изменяются свойства однотипных кислот HClO - HBrO - HIO:
• устойчивость увеличивается, окислительные свойства уменьшаются.
№ 9
Как изменяются в ряду HClO3-HBrO3-HIO3.
• кислотные свойства ослабевают, устойчивость повышается.
№ 10
Укажите формулу перхлората аммония:
• NH4ClO4.
№ 11
Строение внешнего электронного слоя атомов элементов VIA-группы.
• ns2np4.
№ 12
Какая степень окисления является наиболее устойчивой для кислорода?
• (-2)
№ 13
Наиболее устойчивые степени окисления серы в соединениях.
• (-1; +4; +6)
№ 14
Какую степень окисления проявляет кислород в соединениях: а) фторид кислорода; б) пероксид водорода.
• (+2; -1)
№ 15
Расставьте коэффициенты в уравнении реакции взаимодействия серы с горячим раствором щёлочи, протекающей по схеме:
S+NaOH → Na2S+Na2SO3+H2O. Введите сумму всех коэффициентов.
• (15)
№ 16
Определите для молекулярной частицы SO3: а) тип гибридизации орбиталей атома серы; б)пространственную конфигурацию этой молекулярной частицы.
• a) sp2, б) плоская треугольная.
№ 17
Определите молярные массы эквивалентов сероводородной кислоты (г/моль) в реакциях между приведёнными веществами:
а) H2S+2KOH →
б) H2S+KOH →
• (17; 34)
№ 18
Расставьте коэффициенты в уравнении реакции, протекающей по схеме: Zn+H2SO4(конц.) → ZnSO4+S+H2O. Вычислите фактор эквивалентности серной кислоты (f = 1/z).
• (1/6 0.17 0.167 0,17)
№ 19
Укажите для какой системе система (А) является окислителем:
(А) SO4+10H++8e=H2S+4H2O, E0=+0,309 B.
• Cr3++3e=Cr, Eo=-0,704 B.
№ 20
Каковы степени окисления серы в тиосульфате натрия: а) высшая; б) низшая ?
• (+6; -2)
№ 21
Укажите строение внешнего электронного слоя атомов элементов VA -группы.
• ns2np3.
№ 22
Как изменяются в ряду N - P - As - Sb - Bi свойства элементов VA-группы:
• электроотрицательность понижается, металлические свойства усиливаются.
№ 23
Какой молекулярной частице принадлежит электронная конфигурация (ММО):
[KK(σ2s)2(σ2s)2(π2py)2(π2pz)2(σ2px)2] ?
• N2.
№ 24
Расставьте коэффициенты в реакции взаимодействия белого фосфора с горячим раствором гидроксида калия, протекающего по схеме: P+KOH → K(H2PO2)+PH3. Введите сумму всех коэффициентов.
• (14)
№ 25
Какие из оксидов азота являются солеобразующими ?
• N2O3;
• NO2;
• N2O5.
№ 26
Какое вещество преимущественно получается при при взаимодействии цинка с разбавленной азотной кислотой ?
• NH4NO3.
№ 27
Растворы каких солей азотной кислоты имеют рН<7?
• CuSO4;
• NH4NO3.
№ 28
Определите молярную массу эквивалентов фосфорной кислоты (г/моль) в реакции взаимодействия с 2 моль гидроксида калия.
• (49)
№ 29
Укажите для комплексного иона-аммиаката [Ag(NH3)2]+ тип гибридизации и пространственную структуру.
• sp, линейная.
№ 30
Составьте уравнение окисления золота царской водкой (1 объём концентрированной азотной кислоты и 3 объёма концентрированной соляной кислоты) с образованием H[AuCl4]. Чему равна сумма всех коэффициентов?
• (10)
№ 31
Укажите строение внешнего электронного слоя атомов элементов IVA -группы.
• ns2np2.
№ 32
Какие элементы IVA - группы объединяют в подгруппу германия?
• (Ge; Sn; Pb)
№ 33
Основные степени окисления атомов элементов IVA - группы в соединениях (всего 3).
• (-4; +2; +4)
№ 34
Как изменяются свойства элементов IVA - группы с увеличением заряда ядра:
• относительная электроотрицательность уменьшается, металлические свойства усиливаются.
№ 35
Тип гибридизации атомов углерода: а) в графите и б) в алмазе.
• a) sp2, б) sp3.
№ 36
Расставьте коэффициенты в реакции растворения свинца горячей концентрированной азотной кислотой, протекающей по схеме: Pb+HNO3 → Pb(NO3)2+NO2↑ +H2O. Введите сумму всех коэффициентов.
• (10)
№ 37
Используя метод молекулярных орбиталей (ММО) составьте электронную структуру молекулярной частицы СО. Укажите для этой частицы: а) порядок связи; б) магнитные свойства (парамагнитная или диамагнитная).
• 3, б) диамагнитная.
№ 38
Оксид углерода (II) образует комплексы, называемые карбонилами. Какой состав имеют: а) карбонил железа; б) карбонил марганца?
• Fe(CO)5, Mn2(CO)10.
№ 39
рН водных растворов солей: а) карбонатов; б) силикатов щелочных металлов.
• >7.
№ 40
Растворимые соли свинца:
• нитраты;
• ацетаты.
№ 41
Укажите строение валентного электронного слоя атомов элементов VIB - группы: а) хрома; б) вольфрама.
• a) 3d54s1, б) 5d44s2.
№ 42
Какое вещество выпадает в осадок при сливании водных растворов Сr2(SO4)3 и Na2S при комнатной температуре (случай необратимого гидролиза) ?
• Cr(OH)3.
№ 43
Определите направление протекания реакции: а) в прямом или б) обратном) протекает следующий окислительно-восстановительный процесс при стандартных условиях?
Cr2O72-+6Fe2++14H+ ⇔ 2Cr3++6Fe3++7H2O.
Cr2O72-+14H++6е=2Cr3++7H2O, E0=+1,33 B
Fe3++1e=Fe2+, E0=+0,77 B
Укажите направление протекания реакции:
• в прямом.
№ 44
Чему равен фактор эквивалентности (f = 1/z) дихромата калия в реакции восстановления до хрома(III) ?
• {1/6, 0.17, 0.167, 0,17}
№ 45
Укажите для карбонила хрома: а) молекулярную формулу; б) степень окисления хрома в карбониле.
• a) Cr(CO)6, б) 0.
№ 46
Укажите среди оксидов элементов VI группы только кислотные оксиды:
• MoO3,
• WO3,
• СrO3.
№ 47
В водных растворах хромат и дихромат - ионы образуют равновесную систему. а) Во что превращаются в кислой среде хроматы? б) Во что переходят в щелочной среде дихроматы?
• а) в дихроматы, б) в хроматы.
№ 48
Укажите для каких систем (1,2,3 или 4) система (А) является окислителем:
(А) CrO42-+8H++3e=Cr3++4H2O, Eo=+1,45 В
1) 2HClO+2Н++2e=Cl2+2H2O, Eo=+1,63 B;
2) H2SO3+4H++4e=S+3H2O, Eo=+0,45 B;
3) NO+2H++e=NO2+H2O, Eo=+0,80 B;
4) J2(кр)+2e=2J-, Eo=+0,54 B.
• (2; 3; 4)
№ 49
Составьте уравнение реакции растворения хрома в горячей азотной кислоте. Определите сумму коэффициентов в левой и правой частях уравнения.
• (14)
№ 50
Установите геометрическую структуру комплексного иона: [Сr(H2O)6]3+.
• октаэдр.
№ 51
Укажите строение валентного электронного слоя атомов элементов VIIB - группы.
• (n-1)d5ns2.
№ 52
Какие степени окисления наиболее характерны для атомов элемента марганца в соединениях?
• (+2; +4; +7)
№ 53
Как изменяется химическая активность металлов в ряду Mn → Tc → Re?
• понижается.
№ 54
Как относится марганец к концентрированным серной и азотной кислоте на холоду:
• пассивируется.
№ 55
Составьте уравнение реакции растворения рения в разбавленной азотной кислоте (Re окисляется до рениевой кислоты, HReO4). Укажите коэффициент перед азотной кислотой.
• (7)
№ 56
В какой среде перманганат калия является более сильным окислителем?
• в кислой.
№ 57
До какого состояния восстанавливается ион MnO4- в нейтральной среде?
• MnO2.
№ 58
Как изменяются с увеличением степени окисления марганца кислотные свойства оксидов и гидроксидов марганца?
• увеличиваются.
№ 59
Как изменяется в ряду HMnO4 → HTcO4 → HReO4 свойства этих кислот: устойчивость и сила кислоты?
• устойчивость возрастает, сила кислоты уменьшается.
№ 60
Составьте уравнение реакции. Укажите сумму всех коэффициентов: MnO2+KNO3+KOH → K2MnO4+KNO2+H2O.
• (7)
№ 61
Укажите электронную структуру атома железа:
• ...3d64s2.
№ 62
Какие степени окисления наиболее характерны для атомов элементов семейства железа в соединениях?
• (+2; +3)
№ 63
Какая степень окисления является наиболее устойчивой для железа?
• (+3)
№ 64
Как называется минерал, имеющий формулу Fe3O4(FeO*Fe2O3)?
• магнетит.
№ 65
В ряду Fe - Co - Ni устойчивость соединений с низшей степенью окисления возрастает.
№ 66
Какие координационные числа характерны для комплексных соединений семейства железа?
• 4, 6.
№ 67
Какова сумма всех коэффициентов уравнения реакции взаимодействия железа с разбавленной азотной кислотой?
• 9.
№ 68
Как изменяются с увеличением степени окисления железа кислотные свойства оксидов и гидроксидов железа?
• возрастают.
№ 69
Введите через точку с запятой для комплексного соединения [ Ni(NH3)6](NH3)2: степень окисления комплексообразователя; координационное число; заряд комплексного иона.
• (+2; 6; 2+)
№ 70
Какое из соединений называют гексациано(III)феррат калия (красная кровяная соль) ?
• K3[Fe(CN)6].
№ 71
Укажите электронную структуру атома меди:
• 3d104s2.
№ 72
Какие степени окисления наиболее характерны для атомов элементов IВ-группы?
• (+1; +2; +3)
№ 73
Какая степень окисления является наиболее устойчивой для меди?
• (+2)
№ 74
Какая степень окисления является наиболее устойчивой для золота ?
• (+3)
№ 75
Укажите среди природных минералов меди: малахит и куприт.
• (СuOH)2CO3;
• Cu2O.
№ 76
Исходя из положения в электрохимическом ряду, выберите растворители для меди:
• конц.H2SO4;
• разб.HNO3.
№ 77
Лучшим растворителем золота является :
• HCl, насыщенная хлором.
№ 78
Для каких из приведённых оксидов выделены соответствующие гидроксиды?
• СuO и Au2O3.
№ 79
Между какими из попарно приведённых веществ возможна химическая реакция?
• Ag и HNO3(разб.).
• Au и смесь конц. HCl и конц. HNO3.
• (СuOH)2CO3 и HCl.
№ 80
Укажите реакцию водных растворов солей меди и сильных кислот (рН).
• pH < 7.
№ 81
Какие из элементов II группы периодической системы Д.И. Менделеева относятся к подгруппе цинка (II B-группа)?
• цинк;
• кадмий;
• ртуть.
№ 82
Укажите электронную структуру атома цинка:
• ...3d104s3.
№ 83
Какая степень окисления наиболее характерна для атомов элементов IIB- группы?
• (+2)
№ 84
С какими кислотами взаимодействует цинк?
• HCI.
• HNO3 (разб.).
• H2SO4 (разб.).
• HNO3 (конц).
• H2SO4 (конц.).
№ 85
Определите, чему равна сумма всех коэффициентов в уравнении реакции, протекающей по схеме: Zn+H2SO4(конц.) → ZnSO4+H2S+H2O.
• (18)
№ 86
1,6 г кальция и 2,61 г цинка вытесняют из раствора кислоты одинаковые объемы водорода. Вычислите молярную массу эквивалентов цинка (г/моль), если молярная масса эквивалентов кальция равна 20 г/моль.
• (32,695)
№ 87
Укажите реакцию водных растворов солей, образованных ионами цинка и анионами сильных кислот (рН).
• pH < 7.
№ 88
Укажите соли, гидролизующиеся по катиону:
• Cr(NO3)3,
• ZnCl2.
№ 89
Определите для комплексного соединения состава: [ Zn(NH3)4]Cl2. 1.Заряд комплексного иона. 2. Координационное число. 3. Заряд комплексообразователя.
• (2+; 4; 2+)
№ 90
Установите геометрическую структуру комплексного иона: [ Zn(NH3)4]2+.
• тетраэдрическая.
№ 91
Укажите строение внешнего электронного слоя атомов IIA -группы.
• ns2.
№ 92
Какие соли обуславливают общую жёсткость природной воды?
• K2SO4.
• Ca(HCO3)2.
№ 93
Какое соединение называется гашёной известью?
• Ca(OH)2.
№ 94
Присутствие каких солей в природной воде обуславливает карбонатную жёсткость?
• Ca(HCO3)2.
• Mg(HCO3)2.
№ 95
Вычислить в ммоль/дм³: а) временную, б) постоянную и в) общую жесткость воды, в 100 дм³ которой содержится 22,0 г гидрокарбоната магния и 13,6 г сульфата кальция.
• (3; 2; 5)
№ 96
Какие из солей не подвергается гидролизу:
• LiNO3,
• Ca(NO3)2.
№ 97
Определить объём раствора (см³) хлороводородной кислоты с молярной концентрацией эквивалентов HCl 0,1 моль/дм³, необходимый для реакции с гидрокарбонатном кальция, содержащимся в 200 см³ природной воды.
• (10)
№ 98
Какова сумма коэффициентов в уравнении: Mg+HNO3(разб.) → Mg(NO3)2+N2O+H2O.
• (24)
№ 99
Раствор какой соли имеет рН<7 ?
• MgCl2.
№ 100
Укажите продукты реакции, образующиеся при сливании водных растворов солей: сульфата алюминия и карбоната натрия.
• Al(OH)3, CO2, Na2SO4.
| на главную | база по специальностям | база по дисциплинам | статьи |
Другие статьи по теме
