
Химия - 1
для экологов
Якунина Г.М.
Кафедра ТРЭА
Томск-2000

№ 1
Ионное уравнение Ba2++SO42-=BaSO4
выражает сущность химических реакций:
• BaCl2+H2SO4=BaSO4+2HCl;
• Ba(NO3)2+Na2SO4=BaSO4+2NaNO3.
№ 2
Графическое изображение формулы и название соли (Cr(OH)2)2SO4:
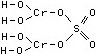
• сульфат дигидроксохрома (Ш).
№ 3
Степень окисления хлора в соединении Mg(ClO4)2:
• +7.
№ 4
Основные остатки, их заряд и оксид, отвечающие соединению Cr(OH)3:
• Cr(OH)21+, Cr(OH)2+, Cr3+, Cr2O3.
№ 5
Формулы оксидов серебра, бария и алюминия:
• Ag2O, BaO, Al2O3.
№ 6
Вещества, которые могут вступить в химическое взаимодействие:
• ZnO, SO3.
№ 7
Возможные кислотные остатки (анионы), их заряд и оксид, отвечающие двуфосфорной кислоте H4P2O7:
• H3P2O73-, H2P2O71-, HP2O72-, P2O73-, P2O5.
№ 8
Изображение и название соли Cd(HSO3)2:
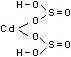
• гидросульфит кадмия.
№ 9
Г-эквивалент соединений HMnO4, Mn(OH)2, MnO2:
• 120; 44,5; 21,75.
№ 10
Степень окисления марганца Mn равна 4+ в соединениях:
• H2MnO3, MnO2.
№ 1
Отличие энтропии от теплоемкости, учитывая физический смысл этих величин:
• в том, что энтропия - количество энергии, рассеиваемое единицей массы на каждый градус температуры, а теплоемкость - тепло, идущее на нагревание единицы массы на один градус.
№ 2
Для расчета теплового эффекта химической реакции необходимы величины:
• значения стандартных теплот образования или сгорания всех веществ, участвующих в реакции.
№ 3
Аморфное вещество постепенно самопроизвольно превращается в кристаллическое. Знак изменения изобарного потенциала, энтальпии и энтропии при переходе вещества из аморфного состояния в кристаллическое:
• ΔH<0, ΔS<0, ΔG<0.
№ 4
Металлы в порядке возрастания их удельных теплоемкостей:
• Sn Cu Ni Fe Mg.
№ 5
Энтропия при нагревании 1 моля хлорида натрия от 25 до 1073 градусов Цельсия, если температура плавления 800 С:
• Увеличится.
№ 6
Формулировки законов в порядке понижения общности (т.е. в таком порядке, чтобы каждый последующи входил в предыдущий или вытекал из него).
1) Переходы всех видов энергии друг в друга происходят в строго эквивалентных отношениях.
2) Для разложения химического соединения необходимо затратить столько теплоты, сколько ее выделится при его образовании.
3) Тепловой эффект химической реакции не зависит от пути процесса, а зависит от начального и конечного состояний реакции.
4) Теплота реакции равна разности сумм теплот образования полученных и исходных веществ.
№ 7
Уравнение Кирхгофа имеет вид d(ΔH)/dT=ΔCp, где ΔH - энтальпия реакции:
ΔCp=∑(nΔCp)кон-∑(nΔCp)нач. При повышении температуры, если ΔCp>0:
• ΔH - реакции будет увеличиваться.
№ 8
Энтропия в изолированной системе при необратимых процессах в ней:
• увеличится.
№ 9
Уравнение U=f(V,S) имеет вид dU=TdS-PdV. Внутренняя энергия увеличивается:
• с ростом энтропии и объема.
№ 10
Для реакции 3Fe3O4(T)+8Al(T)=4Al2O3(T)+9Fe(T) ΔH=-3346.57 кДж и S=-542.72 Дж/К при 25° C. Направление процесса при повышении температуры:
• ΔG<0, процесс возможен. Направление процесса не изменится.
№ 1
При изменении условий протекания реакции H2+J2 ↔ 2HJ-12.4 ккал выход HJ будет максимальным:
• При повышении температуры.
№ 2
Константу равновесия химической реакции 2GaAs(Г)+3ZnCl2(Г) ↔1400° 2GaCl3(Г)+3Zn+1/2 As4(Г) математически правильно выражает равенство:
•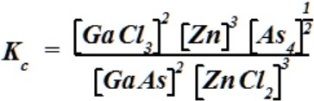 .
.
№ 3
Равновесие смещается в сторону прямой реакции при уменьшении давления:
• 2H2S ↔ 2H2+S2(Г).
№ 4,7,4_3
Закон действия масс:
• 2NO+O2 → 2NO2, V=k(NO)2(O2).
• FeOТ+H2 → Fe+H2O, V=k(H2).
• 2CO+O2 → 2CO2, V=k(CO)2(O2).
№ 5
Скорость реакции увеличится в 27 раз, если концентрацию реагирующих веществ увеличить в 3 раза:
• 3Cl2+2AlТ → 2AlCl3.
№ 6
Смещение равновесия при повышении давления:
• 2N2O ↔ 2N2+O2 ← .
№ 8
Выход будет максимальным, если реакция протекает по уравнению: N2+O2 ↔ 2NO-180.74 кДж:
• При повышении температуры.
№ 9
Скорость реакции увеличится в 4 раза при повышении концентрации реагирующих веществ в 2 раза:
• CO+Cl2 → COCl2.
№ 10
4GaAs(T)+4HJ(г) ↔ 4GaJ(г)+As4(г)+2H2(г). Константа равновесия реакции:
• 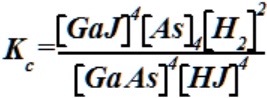 .
.
№ 1
4GaAs(г)+2J2(г) →1200°C 4GaJ(г)+As4(г), константа равновесия:
• Kc=((GaJ)4(As4)) / ((Ga$As)4(J2)2).
№ 2
При повышении температуры наблюдается смещение равновесия в сторону прямой реакции:
• CO2+H2 ↔ CO+H2O -42.84 кДж.
№ 4
Добиться максимального выхода СО, если реакция протекает по уравнению CO2+H2 ↔ CO+H2O -42.84 кДж:
• Повысить давление.
№ 5
Скорость реакции увеличится в 27 раз, если объем газовой смеси увеличить в три раза:
• 2SO2+O2 → 2SO3.
№ 6
Термодинамическая степень свободы:
• Независимые параметры системы, значения которых можно произвольно менять при условии, что число фаз не изменяется.
№ 7
Максимальное число фаз, которыми обладает система, состоящая из раствора хлорида меди (П) в воде.
• 4.
№ 8
Кривая охлаждения для аморфного вещества.
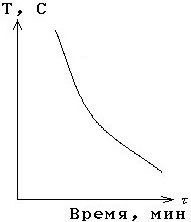
№ 9
Диаграмма двухкомпонентной системы.
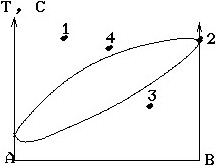
Отражение кривой охлаждения для систем, указанных точками 1, 2, 3, 4.
• 
№ 10
Назовите тип диаграммы.
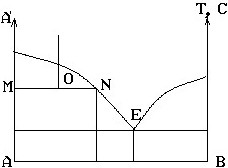
Правило рычага, если Р - вес расплава, Рк - вес выделившихся кристаллов.
• Pk / P = ON / MN.
№ 1
Фаза:
• Гомогенная часть системы, находящаяся в одном и том же агрегатном и модификационном состоянии и обладающая одинаковыми термодинамическими параметрами.
№ 2
Цианамид кальция получают нагреванием в печи карбида кальция в атмосфере азота по реакции: CaC2(т)+N2(г) ↔ CaCN2(т)+C(т). Фазовый состав и число степеней свободы:
• 4, 1.
№ 3
Кривая охлаждения для чистого кристаллического вещества.
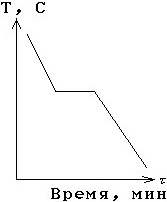
№ 4
Диаграмма состояния.
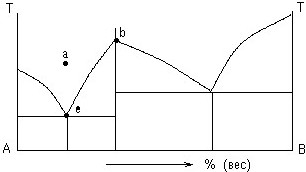
Число степеней свободы в точках a, e, b.
• 2 0 1.
№ 5
Число степеней свободы при затвердевании расплавленного:
а) чистого металла - 0;
б) сплава из двух металлов, образующих одну кристаллическую структуру - 1;
в) сплава из двух металлов, образующих две кристаллические структуры - 0.
№ 6
Значения квантовых чисел для 4р3 электронов:
• n=4 l=1 ml=+1,-1,0.
№ 7
Электронная формула атома элемента содержит конфигурацию 4р3 (внешний слой). Период, подгруппа и характер оксида, соответствующего высшей степени окисления:
• 4 V-A кислотный.
№ 8
При заполнении квантового слоя электронами допущена ошибка:
• слой N | n (число электронов) = 22 | электронная формула слоя - 4s24p64d24f12.
№ 9
Формулы оксидов элементов, имеющих s2, s2p1 и s2p2 электронные конфигурации последнего квантового слоя:
• ЭO, Э2O3, ЭO2.
№ 10
Расположение электронов в энергетических ячейках для атома кремния согласно принципа Паули и правила Гунда:
| 1s2 | 2s2 | 2p6 | 3s2 | 3p6 | 3d10 |
| ↑↓ | ↑↓ | ↑↓ ↑↓ ↑↓ | ↑↓ | ↑↑ |
№ 1
Значения квантовых чисел для 5d7-электронов:
• n=5 le=2 ± ms=[+1/2] 5, 1, 0 ± ml=[-1/2] 2.
№ 2
Квантовые слои электронов:
| слой | n | число электронов | электронная формула слоя |
| M | 3 | 17 | 3s23p63d9 |
| O | 5 | 21 | 5s25p65d105f13 |
| N | 4 | 15 | 4s24p64d7 |
| L | 2 | 7 | 2s22p5 |
№ 3
Заполнение внешних электронных уровней и подуровней электронами у атома элемента данного периода с учетом правила Клечковского.
| z | период | число электронов | электронная формула |
| 38 | 5 | 2 | 5s2 |
| 50 | 5 | 14 | 5s24d105p2 |
| 72 | 6 | 18 | 6s24f145d2 |
| 82 | 6 | 28 | 6s24f145d106p2 |
№ 4
Внешний уровень атома выражается электронной формулой 6s26p4. Порядковый номер элемента, период, подгруппа, характер высшего оксида, элемент, семейство.
• 84 6 VI-A кислотный Po p.
№ 5
Расположение электронов в энергетических ячейках предпоследнего и последнего квантовых слоев у атома ниобия с учетом правил Гунда и Клечковского. Полная электронная формула для атома ниобия.
| n=4 | n=5 | |||
| 4s2 | 4p6 | 4d10 | 5s2 | 5p6 |
| ↑↓ | ↑↓ ↑↓ ↑↓ | ↑ ↑ ↑ | ↑↓ | |
№ 1
Раствор:
• гомогенная система, состоящая из двух или более независимых компонентов, соотношения между которыми могут изменяться.
№ 2
Насыщенным раствором называется такой раствор:
• который находится в равновесии с твердой фазой растворенного вещества и содержит максимально возможное при данных условиях количество этого вещества. В насыщенном растворе в единицу времени одинаковое число молекул переходит в раствор и выделяется из него в твердую фазу.
№ 3
Пересыщенным раствором:
• который содержит вещества больше, чем это следует из его растворимости при данных условиях. Пересыщенные растворы обычно получают путем охлаждения растворов, насыщенных при более высокой температуре.
№ 4
Подвергаются гидролизу:
• Na2CO3, CuSO4.
№ 5
Концентрация ионов водорода в растворе равна 2,5×10-2 моль/л. рН раствора:
• 4,6.
№ 6
Концентрация ионов водорода в растворе, рН которого 2,4:
• 4×10-3.
№ 7
Плотность раствора и αдисс NaOH считать равным единице. рН 0,04%-ного раствора NaOH:
• 12.
№ 8
0,1 н. раствора CН3СООН (степень диссоциации αдисс=1,3 %). рН=:
• 2,89.
№ 9
Молярная концентрация раствора:
• показывает количество грамм-молекул вещества, растворенного в одном литре раствора.
№ 10
Чтобы приготовить 500 г 8%-ного раствора гидроокиси калия нужно взять:
• 40 г вещества.
№ 11
Воды нужно взять для приготовления 2 кг 5%-ного раствора:
• 1,9 кг.
№ 12
Гидроокиси натрия и воды для приготовления 0,5 л 20%-ного раствора:
• 122,5 г и 490 мл.
№ 13
Количество 60%-ного раствора и воды для приготовления 5 кг 10%-ного раствора:
• 4,165 кг.
№ 14
Для того, чтобы приготовить 1 л 20%-ной кислоты, нужно:
• 202 мл 70%-ной серной кислоты.
№ 15
Нормальная концентрация раствора КОН, если на нейтрализацию 0,035 л 0,3 н. H3РО4 израсходовано 0,02 л раствора КОН.
• 0,53 н.
№ 16
Водородным показателем называется:
• десятичный логарифм концентрации ионов водорода, взятый с обратным знаком.
№ 17
Гидролиз соли:
• Процесс взаимодействия ионов растворенной соли с водой, приводящий к образованию слабых электролитов.
№ 18
Степень гидролиза:
• Отношение числа гидролизованных молекул соли к общему числу молекул соли, находящихся в растворе.
№ 19
Реакция растворов следующих солей: АlСl3, K2O, ZnSО4:
• кислая; щелочная; кислая.
№ 20
Гидролиз соли BeCl2:
• BeCl2+HOH ⇔ BeOHCl+HCl, Be2++2HOH ⇔ BeOH1++H1+, pH<7.
№ 21
Осмос:
• односторонняя диффузия через полупроницаемую перегородку.
№ 22
Закон Вант Гоффа:
• Осмотическое давление разбавленного раствора численно равно тому давлению, которое производило бы данное количество растворенного вещества, занимая в виде газа при данной температуре объем, равный объема раствора.
№ 23
Закон Рауля:
• Относительное понижение давления насыщенного пара растворителя над раствором равно мольной доле растворенного вещества.
№ 24
Эбуллиоскопическая константа растворителя:
• Повышение температуры кипения одномоляльного раствора называется эбуллиоскопической константой растворителя Екип.
№ 25
Криоскопическая константа растворителя:
• Понижение температуры замерзания одномоляльного раствора называется криоскопической константой растворителя Езам.
№ 26
Закон Генри:
• Масса газа, растворяющегося при данной температуре в жидкости данного объема, прямо пропорциональна давлению.
№ 27
Степенью электролитической диссоциации (α) называют:
• отношение числа молекул, распавшихся на ионы к исходному числу молекул.
№ 28
Буферными называют растворы,
• способные сохранять значение рН при разбавлении или добавлении небольших количеств кислоты или щелочи.
№ 29
Коллоидные системы:
• Системы, содержащие столь мелкие частицы, радиус r которых превышает 0,1 мк (10-7 м), но все же меньше обычных молекул (еще более мелкие частицы уже не образуют отдельной фазы).
№ 30
Дисперсными называются системы,
• состоящие из двух или более веществ (компонентов) и содержащие две (или более) фазы, причем одна из фаз в виде мельчайших частиц распределена в другой фазе.
№ 31
Гранулы:
• Коллоидные частички с адсорбированными ионами.
№ 32
Мицеллы:
• Гранулы, связанные с ионами противоположного знака.
№ 33
Коагуляция:
• Нейтрализация электрических зарядов гранул, приводящая к укрупнению частиц в более сложные агрегаты.
№ 34
Электрофорез:
• Перемещение коллоидных частиц под действием электрического тока.
№ 35
Растворимость вещества зависит:
• как от его природы, так и от природы растворителя.
№ 1
ZnS - сложный полупроводник. Тип связи и тип проводимости:
Изменится ли проводимость при легировании сурьмой:
а) твердый раствор внедрения;
б) твердый раствор замещения.
• Связь ковалентная (2) и донорно-акцепторная (2). Проводимость электронно-дырочная. При легировании в случае а - проводимость электронная, в случае б - дырочная.
№ 2
Тип гибридизации орбиталей атома Zn в молекуле ZnF2:
• sp.
№ 3
CdTe0.95 - сложный полупроводник нестехиометрического состава. Тип связи, тип проводимости:
• Связь ковалентная (2) и донорно-акцепторная (2), проводимость электронная.
№ 4
Тип гибридизации орбиталей атома углерода в молекуле CH4, если форма молекулы тетраэдрическая:
• sp3.
№ 5
AlSb - сложный полупроводник. Тип связи и проводимость. Изменится ли тип проводимости при легировании цинком (твердый раствор внедрения):
• Ковалентная (3) и донорно-акцепторная (1) связь, проводимость собственная, при легировании проводимость электронная.
№ 6
Тип гибридизации орбиталей азота в молекуле NH3.
• sp3.
№ 7
JnSb0.9 - сложный полупроводник нестехиометрического состава. Тип связи и тип проводимости:
• Ковалентная (3) и донорно-акцепторная (1) связь, электронная проводимость.
№ 8
Молекула BCl3, если она имеет треугольную геометрическую формулу, отвечает типу гибридизации:
• sp2.
№ 9
Геометрическая конфигурация молекул BF3 и NF3:
• неодинакова.
№ 10
Большим поляризующим действием обладает ион:
• Al3+.
| на главную | база по специальностям | база по дисциплинам | статьи |
Другие статьи по теме
