
Химия. Часть 2
для экологов
Смирнов Г.В., Якунина Г.М.
Кафедра РЭТЭМ
Томск-2000
№ 1
Магниевую пластинку опустили в раствор его соли. При этом электродный потенциал магния оказался равен –2,41 В. Концентрация ионов магния:
• 4,4*10-2 моль/л.
№ 2
У катода при электролизе раствора K2SO4, если на аноде выделилось 11,2 л кислорода (н.у.), образовалась масса гидроксида калия:
• 112,22 г.
№ 3
Константа нестойкости комплекса (Fe(CN)6-)4-:
• 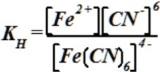 .
.
№ 4
Водород в своих соединениях может проявлять степень окисления:
• –1,+1.
№ 5
Взаимодействие бериллия с гидроксидом калия:
• Be+2KOH→K2BeO2+H2.
№ 6
Виды хроматографии в зависимости от состава фаз:
• адсорбционная, ионообменная и распределительная.
№ 7
- от агрегатного состояния разделяемой смеси:
• газовая, жидкостная, газожидкостная.
№ 8
В 500 л воды содержится 202,5 г Са(НСО3)2. Жесткость:
• 5 мг-экв.
№ 9
Жесткость, обусловленная присутствием CaSO4, равна 4 мг-экв. В 1 м³ воды содержится:
• 272,28 г этой соли.
№ 10
Чтобы устранить жёсткость, равную 5 мэкв, надо добавить к 500 л воды:
• 132,5 г соды.
№ 11
На титрование 100 см³ воды, содержащей гидрокарбонат кальция, потребовалось 6,25 см³ 0,08н. раствора HCl. Карбонатная жёсткость воды была
• 5 мг-экв.
№ 12
Сероводород в окислительно-восстановительных реакциях:
• окислитель и восстановитель.
№ 13
Азот проявляет низшую степень окисления в соединении:
• NH4NO3.
№ 14
Кусок латуни обработали азотной кислотой. Раствор разделили на две части. К одной из них прибавили избыток раствора аммиака, к другой — избыток раствора щелочи. При этом образуются соединения цинка и меди:
• Na2[Zn(OH)4], [Cu(NH3)4](NO3)2.
№ 15
Взаимодействие V2O3 и V2O5 с H2SO4 и NaOH:
• V2O3+H2SO4→(V2SO4)3; V2O5+NaOH→Na3VO4+H2O.
№ 16
На гидроксиды цинка и кадмия подействовали избытком растворов серной кислоты, гидроксида натрия и аммиака. В каждой из этих реакций образуются соединения цинка и кадмия:
• ZnSO4, CdSO4, Na2[Zn(OH)4], Cd(OH)2, [Zn(NH3)4]SO4, [Cd(NH3)4]SO4.
№ 17
Определение иона двухвалентного железа:
• 3FeSO4+2K3[Fe(CN)6]=Fe3[Fe(CN)6]2↓+3K2SO4.
№ 18
Степень окисления марганца при восстановлении KMnO4 в кислой, нейтральной, и щелочной средах:
• 2, 4, 6.
№ 19
Определение иона Fe3+ в растворе:
• FeCl3+3NH4CNS⇔Fe(CNS)3+3KCl;
• 4FeCl3+3K4[Fe(CN)6]⇔Fe4[Fe(CN)6I↓+12KCl.
№ 20
К алканам относится:
• СН3-СН2-СН3.
№ 21
Классификация органических соединений по типу молярных цепей:
• альдегиды и кетоны;
• ациклические, карбоциклические, гетероциклические соединения.
№ 22
Объем воздуха (условия нормальные), необходимый для сожжения 7 г фосфора, если продуктом реакции является Р2О3:
• 18,14 л.
№ 23
Элементы с атомными номерами 15, 16 и 20 образуют по одному очень гигроскопичному соединению, которое используется в качестве осушающего средства:
• P, S, Ca, P2O5, H2SO4, CaCl2.
№ 24
Органические вещества А и В представляют собой жидкости. Оба они имеют одинаковые молекулярные массы и одинаковый качественный состав молекул. Вещество А относительно мало растворимо в воде, вещество В смешивается в любых соотношениях, растворимость одного из этих веществ в другом не ограничена. Вещество A получают из ближайшего гомолога вещества В при нагревании этого гомолога с концентрированной серной кислотой. Отношение масс водорода и кислорода, входящих в состав соединений А и В, равно 3 : 8, а масс углерода и кислорода — 3:2. Это вещества:
• А — диметиловый эфир СН3-О-СН3, В — этиловый спирт СН3-СН2-ОН.
№ 25
Среди немногочисленных химических элементов, название которых относится к женскому роду, два элемента образуют между собой соединение ярко-красного цвета, встречающееся в природе:
• Hg, S, HgS.
№ 26
Из смеси двух металлов железа и алюминия выделить металлическое железо. Прилить к смеси:
• гидроксида калия.
№ 27
К алкенам относятся:
• С4Н8, С5Н10.
№ 28
При электролизе водного раствора NaOH на аноде выделилось 2,8 л кислорода (н.у.). На катоде выделилось:
• 5,6 л водорода.
№ 29
В водном растворе [Hg2+]=0,01 моль/л, [Fe3+]=0,01 моль/л, [Fe2+]=0,001 моль/л. Будет протекать реакция:
• 2FeCl3+Hg=2FeCl2+HgCl2.
№ 30
Процесс коррозии железа в кислотной среде покрытого марганцем в случае нарушения покрытия:
• Mn-2e-=Mn2+, 2H++2e-=H2.
№ 31
Общяя формула сложных эфиров:
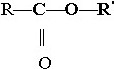
№ 32
Карбоновая кислота:
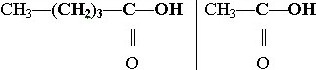
№ 33
Аминокислота:
• Н2N-СН2-СООН.
№ 34
Пять основных элементов в составе белков:
• углерод, водород, кислород, азот, сера.
№ 35
Какие из протеинов не растворяются в воде:
• протеиноиды, проламины, глобулины.
№ 36
При гидролизе образуют белок, жиры и жироподобные вещества:
• липопротеиды.
№ 37
В качестве окислителей при очиске сточных вод используют реагенты:
• Cl2, O3, H2O2, MnO2.
№ 38
- в качестве восстановителей:
• активированный уголь, органические отходы (например, газетная бумага), сульфат железа (II) FeSO4, гидросульфит натрия NaHSO3, диоксид серы SO2, водород.
№ 39
Местность вблизи автострад сильно загрязнена тяжелыми металлами:
• Pb, Zn, Cd.
№ 40
Триметиламин:
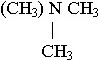
№ 41
Определение иона цинка в растворе:
• ZnCl2+(NH4)2[Hg(CNS)4]=Zn([Hg(CNS)4]↓+2NH4Cl.
№ 42
Электрохимический метод, использующийся для извлечения тяжелых и редких металлов из сточных вод:
• катодное восстановление.
№ 43
Восстановители для очистки от ртутных неорганических соединений:
• FeS, NaHSO3, Fe(порошок), Al(пудра), H2S.
№ 44
Реакции, отражающие разрушение озонового слоя:
• O3+hν=O+O2
O+NO2→NO+O2
NO+O3→NO2+O2
2O3→3O2.
№ 45
Храмотография:
• метод разделения соединений, основанный на распределении вещества между двумя фазами - неподвижной с большей поверхностью и подвижной, проникающей через поднятую фазу.
№ 46
Важнейшие классы органических соединений:
• Углеводороды, спирты, альдегиды, кетоны, карбоновые кислоты, амины.
№ 47
Окислительно-восстановительные реакции для удаления из сточных вод соединений хрома:
• 4H2CrO4+6NaHSO3+3H2SO4=2Cr2(SO4)3+3Na2SO4+10H2O;
2CrO3+3H2SO3=Cr2(SO4)3+10H2O;
Cr2(SO4)3+6NaOH=2Cr(OH)3↓+3Na2SO4.
№ 48
При сплавлении 7,6 г окиси хрома в щелочной среде с хлоратом калия было получено 17,5 г хромата калия. Выход продукта:
• 90,2 %.
№ 49
При нормальных условиях при взаимодействии 15,8 г перманганата калия с концентрированной соляной кислотой можно получить:
• 5,6 литров хлора.
№ 50
С аналитичесской точки зрения, важнейшая реакция карбонатов:
• CO32-+2H-=H2CO3=H2O+CO2; CO2+Ba(OH)2=BaCO3↓+H2O.
№ 51
Важнейшая реакция для открытия иона #math#2(SO,4,2$minus):
• BaCl2+K2SO4=BaSO4↓+2KCl.
№ 52
Тяжёлые металлы:
• Cd, Pb, Fe.
№ 53
При обычных условиях находятся в жидком состоянии:
• ртуть, бром.
№ 54
Из общего числа составляющих земную кору (все три оболочки) являются наиболее распространёнными элементы :
• кислород, водород, кремний.
№ 55
Сущность потенциометрического метода анализа:
• Определение содержания соответствующих ионов в растворе, основанное на измерении потенциала электрода, погруженного в раствор.
№ 56
Техническая жесткость воды (применяемой в промышленности):
• это содержание в ней бикорбанатов и карбонатов, а также других солей кальция и магния.
№ 57
Что такое общая жесткость воды:
• Общая жесткость воды - это суммарное содержание растворимых в воде солей, выражаемая в мэкв/л.
№ 58
• Протеины - это простые белки, а протеиды - сложные (содержат ещё и другие компоненты).
№ 59
α-лучи:
• поток частиц, выбрасываемых при распаде тяжёлых радиоактивных изотопов, представляющих собой ядра гелия с зарядом 2 и массовым числом 4.
№ 60
β-лучи:
• поток быстро летящих электронов, порождаемых внутриядерными преобразованиями при распаде некоторых радиоактивных изотопов.
№ 61
γ-лучи:
• коротковолновое электромагнитное излучение с длиной волны менее 10-8 Мэв (при распаде радиоактивных ядер и элементарных частиц).
№ 62
Спектральный анализ:
• физический метод качественного и количественного определения состава вещества, производимый по его оптическим спектрам при высоких температурах.
№ 63
Трансурановые:
• Химические радиоактивные элементы, расположенные в таблице Д.И.Менделеева с порядковым номером Z выше 92.
№ 64
Получено искусственно:
• 15 трансурановых элементов.
№ 65
Полимеризация:
• процесс образования полимеров путём последовательного образования одинаковых связей между мономерами.
№ 66
Полимер:
• молекула органических соединений, образованная путём связывания в цепь большого числа элементарных звеньев (мономеров).
№ 67
Олигомер:
• молекула органических соединений, образованная путём связывания в цепь небольшого числа элементарных звеньев (мономеров).
№ 68
Сущность фотосинтеза заключается в:
• синтезе органических соединений с помощью энергии света, поглощённой молекулами хлорофилла.
№ 69
При действии избытка щелочи на сульфат бериллия образуется:
• Na2[Be(OH)4].
№ 70
Фермент:
• белок, играющий роль катализатора в биохимических реакциях.
№ 71
Кислотный дождь:
• дождевая вода с пониженным значением рН из-за растворения в ней оксидных загрязнителей воздуха (главным об-разом SO3).
№ 72
Геометрическая форма молекулы метана:
• правильный тетраэдр.
№ 73
Фотохимический смог:
• сложная смесь загрязнителей, образующаяся за счёт взаимодействия солнечного света с атмосферой, насыщенной автомобильными выхлопами. Основные исходные реагенты - смогаоксиды азота и органические соединения, главным образом олефины и альдегиды.
№ 74
Реакции отражающие разрушающее действие хлорфторметанов на озон:
• CFxCl4-x(г)+hν→CFxCl3-x(г)+Cl(г);
Cl(г)+O3(г)→ClO(г)+O2(г);
ClO→Cl(г)+O2(г);
O3(г)+O(г)→2O2(г).
№ 75
FeSO4→Fe2(S04)3 - окисление;
2I04-→I2 - восстановление;
NH3→NO - окисление.
№ 76
Эквивалентная масса перманганата калия как окислителя, если в процессе реакции это вещество восстанавливается:
а) до сульфата марганца;
б) до диоксида марганца;
в) до манганата калия (K2MnO4).
• 31,61 г/моль; 52,68 г/моль; 158,04 г/моль.
№ 77
С помощью 0,1 л 0,25 Нo(нормаль) K2Cr2O7 по реакции Al+K2Cr2O7+H2SO4→Al2(SO4)3+Cr2(SO4)3+K2SO4+H2O можно окислить:
• 0,22 г Al.
№ 78
ЭДС медноцинкового гальванического элемента, если концентрации CuSO4 и ZnSO4 соответственно равны (моль/л): 0,01 и 1; 0,001 и 1:
• 1,04 В; 1,01 В.
№ 79
Эквивалентная масса и эквивалент восстановителя в реакции K2Cr2O7+H2S+H2SO4→K2SO4+Cr2(SO4)3+S+H20:
• 17 г/моль; 1/2 моль.
№ 80
Окислительная эквивалентная масса азотной кислоты в каждой из приведенных реакций:
Hg+HNO3→Hg(NO3)2+NO+H2O;
Sn+HNO3→Sn(NO3)2+N2O+H2O;
Mg+HNO3→Mg(NO3)2+NH4NO3+H2O.
• 21 г/моль; 15,75 г/моль; 7,87 г/моль.
№ 81
Восстановитель и коэффициент перед ним в реакции, протекающей по схеме: KMnO4+H2S+H2SO4→MnSO4+S+K2SO4+H2O:
• S2-, 5.
№ 82
В окислительно-восстановительных реакциях как окислителем так и восстановителем может являться вещество:
• MnO2.
№ 83
В качестве окислителя в реакции FeS+HNO3→S+NO+Fe(NO3)3+H2O участвует:
• 1 молекула азотной кислоты.
№ 84
В раствор азотнокислого серебра опущены цинковая и железная пластинки весом 12,25 г каждая. Пластинки были вынуты, когда на каждой выделилось по 2 г серебра. Вес каждой пластинки, покрытой серебром:
• 13.65; 13.73.
№ 85
При прохождении тока через раствор серной кислоты в течение 10 минут выделилось 672 мл гремучего газа. Сила тока была:
• 6.43 A.
№ 86
При пропускании через раствор соли 965 кулонов электричества было получено на катоде 1,0788 г металла:
• серебра.
№ 87
Величина электродного потенциала серебра в 2 М и 0,01 М растворах:
• 0.802 А и 0.680 А.
№ 88
При электролизе, если у анода выделилось 10 л кислорода, разложилось:
• 128 граммов воды.
№ 89
Реакция NaOH+Br2→NaBrO3+NaBr+H2O относится к:
• реакции диспропорционирования.
№ 90
Проходя через раствор электролита, ток силой 0,5 А за 1 час выделяет 0,55 г металла. Значение электрохимического эквивалента и эквивалентная масса этого металла:
• 0,00031 г; 29,43 г.
№ 91
На катоде при электролизе водного раствора смеси солей KBr и CrCl3 будет практически выделяться:
• Cr.
№ 92
На аноде, при электролизе водного раствора NiCl2 с никелевым анодом, будет окисляться:
• Ni.
№ 93
Продукты электролиза раствора Fr2SO3 (электроды инертные):
• H2 и O2.
№ 94
Коррозия железа интенсивнее протекает при:
• Fe+H2SO4+CuSO4→.
№ 95
Потенциал цинкового электрода, если раствор соли цинка, в который он погружен разбавить в 10 раз:
• уменьшится на 30 мВ.
№ 96
При электролизе раствора хлорида меди (II) масса катода увеличилась на 3,2 г. При этом на медном аноде:
• перешло в раствор 0,05 моля Сu+2.
№ 97
Эквивалентная масса окислителя в реакции K3AsO3+Zn+HCl→KCl+AsH3+ZnCl2+H2O:
• 40 г/моль.
№ 98
Через растворы HCl и NiSO4 пропущено одинаковое количество электричества. Объем выделившегося на аноде хлора при нормальных условиях, если на катоде осело 3 г Ni, равен:
• 1,15 л.
№ 99
Окислить железо (II) до железа (III) способен:
• KMnO4 в кислой среде.
№ 100
При прохождении через раствор соли трехвалентного металла тока силой 1,5 А в течение 30 минут выделилось 1,071 г металла. Металл выделился:
• на катоде, атомная масса - 114,8.
| на главную | база по специальностям | база по дисциплинам | статьи |
Другие статьи по теме
